Qui décide et organise ?
Tout essai clinique doit reposer sur des arguments scientifiques et éthiques valables, et surtout avoir pour but d'encadrer la participation des patients avec le minimum de risques.
En France, la recherche clinique est encadrée depuis 1988 par la Loi Huriet-Sérusclat. Elle organise, sécurise les essais, protège et informe les patients en spécifiant le rôle des différents acteurs et les droits des patients dans les essais.
La Loi Huriet-Sérusclat a été revue par la suite en 1990, en 1995 et dernièrement en août 2004.
Applicable à partir de la mi-2016, le nouveau règlement européen sur les essais cliniques de médicaments vise à mieux coordonner et faciliter les autorisations préalables des essais. Il assure également une plus grande transparence sur les résultats de ceux-ci.
Tout essai nécessite la collaboration de plusieurs acteurs :
Le promoteur
Le promoteur propose le nouveau traitement, à partir d'un rationnel scientifique documenté (données expérimentales, besoin médical..). Le promoteur est la personne physique, la société ou l'institution qui propose de mettre en œuvre un essai thérapeutique et qui assure son financement. Il est responsable devant les autorités administratives du bon déroulement de l'essai thérapeutique et de la diffusion de toute information relative à la sécurité des personnes se prêtant à la recherche.
Les promoteurs peuvent être un groupe académique, une association de recherche médicale, l'industrie pharmaceutique, un médecin..,
Le promoteur rédige un protocole détaillé de l'essai ainsi que la note d'information et le consentement éclairé qui doivent être remis au patient. Ces documents sont ensuite soumis à un Comité de Protection des Personnes (CPP) et à l'Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM) pour évaluation et autorisation.
Le Promoteur va ensuite proposer l'essai à des médecins investigateurs qui participent à l'essai et en assurent le bon déroulement dans leur établissement de soin.
L'investigateur
L'investigateur d'un essai thérapeutique est un médecin. Il propose l'essai et informe le patient, dirige et surveille la réalisation de l'essai. Il est responsable de son déroulement et du respect des bonnes pratiques cliniques, du recueil des informations rendues anonymes et de l'archivage des données dans son centre. En cas de survenue d'un événement indésirable grave, il s'engage à informer immédiatement le promoteur qui en fera la déclaration auprès de l'ANSM. Un centre Investigateur peut être audité par le Promoteur ou les Autorités de Santé.
Le patient
Le patient qui choisira de participer ou non à l'essai clinique.
Qui contrôle les essais cliniques ?
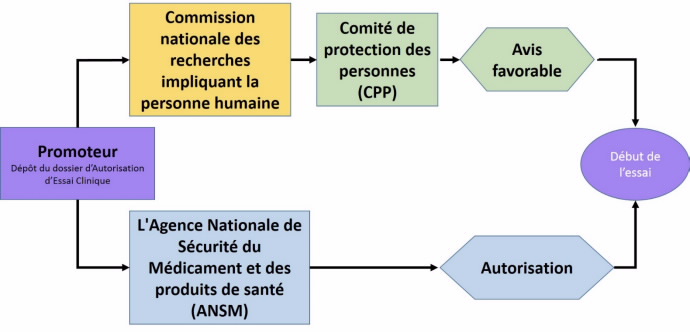
Tout promoteur d'une recherche biomédicale interventionnelle soumet le protocole de celle-ci d'une part à la commission nationale des recherches impliquant la personne humaine qui la transmets à un Comité de Protection des Personnes (CPP) désigné par tirage au sort, d'autre part à l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) qui doit délivrer une autorisation. Ce sont les deux piliers du dispositif réglementaire de contrôle de la recherche en France.
Le Comité de Protection des Personnes (CPP)
Les Comités de Protection des Personnes sont l'une des deux instances chargées d'apprécier le bien-fondé d'une recherche médicale et le respect de tous les droits des personnes appelées à y participer.
L'un des grands principes éthiques – si ce n'est le principal – de la réglementation sur la recherche médicale est que « l'intérêt des personnes qui se prêtent à une recherche prime toujours sur les seuls intérêts de la science et de la société ».
C'est pour garantir ce principe, que le législateur a créé, dès 1988, des comités de protection des personnes (CPP).
Ces comités jouent un rôle essentiel : sans un avis positif de la part de l'un d'entre eux, aucune nouvelle recherche impliquant des patients ne peut être mise en œuvre.
Depuis le décret du 16 Novembre 2016, les membres des CPP seront soumis à un programme de formation organisé par la Commission Nationale des Recherches Impliquant les personnes humaines. Les CPP seront réunis par la Commission au moins une fois par an.
L'Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM)
L'Agence nationale de sécurité du médicament et des produits de santé, anciennement Afssaps, dont elle a repris les missions, droits et obligations. Elle a été dotée de responsabilités et de missions nouvelles, de pouvoirs et de moyens renforcés.
L'ANSM assure la gestion et l'évaluation des recherches biomédicales portant sur les produits de santé et hors produits de santé.
L'Agence évalue la sécurité et la qualité des produits utilisés au cours de la recherche, avec l'objectif de s'assurer que la sécurité des personnes se prêtant à la recherche biomédicale est garantie . » Extrait du site de l'ANSM
- Télécharger la plaquette institutionnelle de l'ANSM
- Voir le site Internet de l'ANSM
La commission nationale des recherches impliquant la personne humaine
La commission nationale des recherches impliquant la personne humaine dépend du ministère de la santé et assure notamment la coordination et l’harmonisation du fonctionnement des CPP. Elle est composée de 22 membres nommés par arrêté du ministre chargé de la santé. Le secrétariat de la commission, assuré par la direction générale de la santé, s’occupe des échanges entre les promoteurs et les CPP. Il reçoit les dossiers des promoteurs et procède par tirage au sort à la désignation d’un CPP qui évaluera le dossier de demande d’essai clinique.
Pour en savoir plus : Décret n° 2016-1537 du 16 novembre 2016 relatif aux recherches impliquant la personne humaine
La Commission Nationale Informatique et Liberté (CNIL)
La CNIL a pour mission essentielle de protéger la vie privée et les libertés individuelles ou publiques face aux dangers que l'informatique peut faire peser sur les libertés. Elle est chargée de veiller au respect de la loi « Informatique et libertés ».
« Tout projet de traitement automatisé de données nominatives ayant pour fin la recherche dans le domaine de la santé doit faire l'objet d'une demande d'autorisation auprès de la CNIL. ».
L'objectif est de protéger les personnes contre les risques liés à la conservation et à l'utilisation des fichiers informatiques.
- Voir le site Internet de la CNIL
- CCTIRS : Comité consultatif sur le traitement de l'information en matière de recherche dans le domaine de la santé
Source La Ligue contre le cancer